來源:網絡資源 2022-11-14 21:04:42
一、酸及酸的化學性質
酸在水溶液中能解離出氫離子(H+)和酸根離子。常見的酸有①鹽酸(HCl)②硫酸(H2SO4) ③硝酸(HNO3)④醋酸(CH3COOH)
①紫色石蕊試液遇酸變紅,無色酚酞試液遇酸不變色。
②活潑金屬+酸鹽+氫氣(注:此處酸不包括濃硫酸和硝酸)
Zn+H2SO4=ZnSO4+H2 Zn+2HCl=ZnCl2+H2
Fe+H2SO4=FeSO4+H2 Fe+2HCl=FeCl2+H2
2Al+3H2SO4=Al2(SO4)3+3H2
2Al+6HCl=2AlCl3+3H2
③金屬氧化物+酸鹽+水
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
CuO+2HCl=CuCl2+H2O
④堿+酸鹽+水
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
⑤*鹽+酸新鹽+新酸
AgNO3+HCl=AgCl+HNO3
BaCl2+H2SO4=BaSO4+2HCl
二、堿及堿的化學性質
堿由離子構成,堿在水溶液中能解離出金屬離子和氫氧根離子(OH-)。
常見的堿有氫氧化鈉(NaOH) 、氫氧化鈣 Ca(OH)2、氨水(NH3·H2O)等。
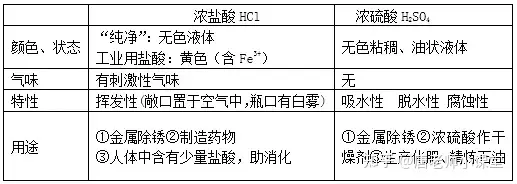
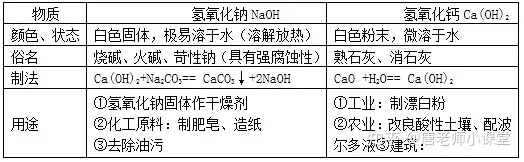
1.氫氧化鈉、氫氧化鈣的物理性質、用途
2.堿的化學性質
紫色石蕊試液遇堿溶液變藍,無色酚酞試液遇堿溶液變紅。
①酸性氧化物+堿鹽+水
2NaOH+CO2=Na2CO3+H2O
*2NaOH+SiO2=Na2SiO3+H2O
Ca(OH)2+CO2=CaCO3+H2O
②酸+堿鹽+水(中和反應)
③*鹽+堿新鹽+新堿(反應物均可溶)
2NaOH+CuSO4=Na2SO4+Cu(OH)2
三、鹽的性質
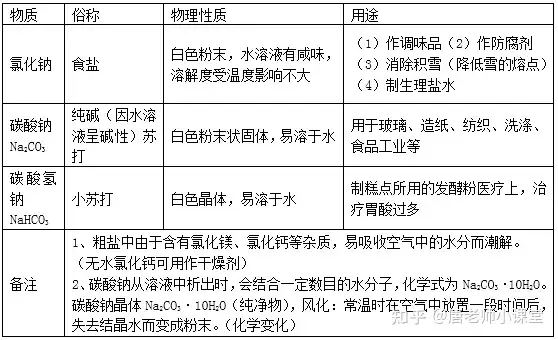
1.常見的鹽
鹽由離子構成,組成里含有金屬離子(或NH4+)和酸根離子的一類化合物。
2.粗鹽提純
去除粗鹽中不溶性雜質。
3.鹽的化學性質
①鹽溶液+金屬新鹽+新金屬(按金屬活動性順序)
CuSO4+Zn=ZnSO4+Cu
CaCO3+2HCl=CaCl2+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
鹽溶液+堿溶液新鹽+新堿(必有一個是沉淀)
Ca(OH)2+Na2CO3==CaCO3+2NaOH(明星反應)
3NaOH+FeCl3=3NaCl+Fe(OH)3
鹽溶液+鹽溶液新鹽+新鹽(必有一個是沉淀)
CaCl2+Na2CO3=CaCO3+2NaCl
AgNO3+NaCl=AgCl+NaNO3
四、明確復分解反應發生的本質
復分解反應:由兩種化合物(通常為酸堿鹽)相互交換成分,生成另外兩種化合物的反應。
通式:AB+CD=AD+CB
發生的條件:生成物中如果有、或有H2O(穩定、難溶、難電離物質)
注意:堿與氧化物的反應不屬于復分解反應
對于復分解反應的三大特點也是同學們必須要記住的,第一反應物,生成物均只有兩種化合物。第二,發生反應的兩種化合物相互交換成分,三個元素的化合價在反應的前后均不發生改變,同學們在判斷是否是復分解反應時,只需要依據以上的條即可辨別。
五、熟記酸、堿、鹽的溶解性口訣
堿溶氨、鈉、鉀、鋇、鈣(俺拿假被蓋)
鉀鈉銨(銨鹽)硝(硝酸鹽)全都溶。
硫酸鹽不溶鋇和鉛;氯化物不溶銀亞汞,碳酸鹽只溶鉀鈉銨。
六、幾個常見離子的檢驗
1.Cl-離子的檢驗 (選)
取少量樣品于試管中,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,樣品含有Cl-, AgNO3+KCl=AgCl+KNO3
2.SO42-離子的檢驗 (選)
取少量樣品于試管中,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,樣品含有SO42-, Ba(NO3)2+H2SO4=BaSO4+2HNO3
3. CO32-離子的檢驗
取少量樣品于試管中,滴加稀HCl,將生成的氣體通入澄清石灰水有無色氣體生成,該氣體使澄清石灰水變渾濁,樣品含有CO32-,
K2CO3+2HCl=2KCl+CO2+H2O
CO2+Ca(OH)2=CaCO3+H2O
4.檢驗NH4+(選)
取少量待檢物于潔凈的試管中,滴入適量NaOH溶液并加熱,有使濕的紅色石蕊試紙變成藍色的氣體產生。
5、鑒別稀鹽酸和稀硫酸
分別取少量待檢液體于兩支潔凈的試管中,各滴入幾滴BaCl2溶液,有白色沉淀產生的原溶液是稀硫酸,無現象產生的原溶液是稀鹽酸。
七、常見俗稱、成分和化學式
生石灰——CaO 熟石灰——Ca(OH)2
石灰石、大理石——CaCO3食鹽——NaCl
火堿、燒堿、苛性鈉——NaOH 純堿、蘇打——Na2CO3 小蘇打——NaHCO3
鐵銹、赤鐵礦——Fe2O3 磁鐵礦——Fe3O4 金剛石、石墨——C 干冰——CO2 冰——H2O 天然氣(甲烷)——CH4
酒精(乙醇)——C2H5OH 醋酸(乙酸)——CH3COOH
八、常見物質的顏色
紅色的固體——Cu、Fe2O3、P(紅磷)
黑色的固體——C、CuO、Fe3O4、FeO、MnO2
白色的固體——KClO3、P2O5、P(白磷)、CuSO4(無水硫酸銅)、KCl、NaCl等
暗紫色的固體——KMnO4
淡黃色的固體——S
藍色晶體——CuSO4•5H2O
藍色沉淀——Cu(OH)2
紅褐色沉淀——Fe(OH)3
白色沉淀(不溶于酸)——BaSO4、AgCl
白色沉淀(碳酸鹽)——CaCO3、BaCO3
白色沉淀(堿)——Mg(OH)2、Al(OH)3
藍色溶液——CuSO4、Cu(NO3)2等含Cu2+溶液
淺綠色溶液——FeSO4、FeCl2等含Fe2+溶液
棕黃色溶液——FeCl3、Fe2(SO4)3等含Fe3+溶液
對于初中階段酸堿鹽的學習,其包含的內容量還是比較多的,那么在學習當中想要快速的掌握這部分的內容,那么對其全面的了解外,還要針對每一部分的內容進行細致的分析,特別其中涉及到的一些簡單的實驗能也能夠幫助大家快速的掌握酸堿鹽各部分的性質。其中重要的一些化學方程式。記憶的口訣都是大家在學習或復習當中比較重要的學習內容。
歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看
C闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻锝夊箣閿濆憛鎾绘煕婵犲倹鍋ラ柡灞诲姂瀵潙顫濋懜娈库偓鏍ㄧ箾鐎涙ḿ鐭婄紓宥咃躬瀵鈽夐姀鐘电杸闂佺ǹ绻愰幗婊堝极閺嶎厽鈷戞繛鑼额嚙楠炴鏌熼悷鐗堝枠妤犵偛鍟灃闁告侗鍘奸悗顓烆渻閵堝棗濮傞柛濠冪墵楠炲鈻庨幇顔剧槇濠电偛鐗嗛悘婵嬪几閻斿皝鏀介柣鎰嚋闊剛鈧鍠栭…閿嬩繆閹间礁鐓涢柛灞剧煯缁ㄤ粙姊绘担鍛靛綊寮甸鍌滅煓闁硅揪瀵岄弫鍌炴煥閻曞倹瀚�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌i幋锝呅撻柛銈呭閺屾盯顢曢敐鍡欘槬缂備胶濮锋繛鈧柡宀€鍠栧畷婊嗩槾閻㈩垱鐩弻娑氣偓锝冨妼閳ь剚绻堝濠氬即閻旇櫣顔曢梺缁樺姦閸撴岸鎮甸弮鍌滅=濞达絾褰冩禍鐐節閵忥絾纭炬い鎴濇川缁粯銈i崘鈺冨幈闂佹枼鏅涢崣鎰板箣閻樿京鍓ㄥ銈嗘尵婵澹曟總鍛婄厓鐟滄粓宕滈悢椋庢殾闁圭儤顨嗛崐鐑芥倵閻㈢櫥鐟邦嚕閹惰姤鈷掑ù锝堟鐢稒绻涢崣澶屽⒌鐎规洘鍔欏畷鐑筋敇濞戞ü澹曞┑顔结缚閸嬫挾鈧熬鎷�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚敐澶婎潊闁虫儼娉涘﹢杈ㄧ珶閺囩喓绡€婵﹩鍘鹃崢鐢告⒑閸涘﹥瀵欓柛娑卞幘椤愬ジ姊绘担铏瑰笡闁圭ǹ顭烽幃鐤槾婵″弶鍔欓獮鎺楀棘閸濆嫪澹曢梺鎸庣箓妤犲憡绂嶅⿰鍕╀簻闁哄洨鍠撻惌鎺楁煛瀹€鈧崰鏍箚閸岀偛浼犻柕澶樼仢濠婂牊鈷戦柛婵嗗閻掕法绱撳鍕獢闁绘侗鍠栭埢搴ㄥ箻瀹曞浂妲规俊鐐€栧濠氬磻閹炬番浜滈煫鍥ュ劜鐎氾拷闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚敐澶婎潊闁虫儼娉涘﹢杈ㄧ珶閺囩喓绡€婵﹩鍘鹃崢鐢告⒑閸涘﹥瀵欓柛娑卞幘椤愬ジ姊绘担铏瑰笡闁圭ǹ顭烽幃鐤槾婵″弶鍔欓獮鎺楀棘閸濆嫪澹曢梺鎸庣箓缁ㄨ偐鑺遍挊澹濆綊鎮╅鑲╀痪闂侀潧娲ょ€氫即鐛幒鏂哄亾閿濆簼绨藉ù鐓庡濮婅櫣鎷犻垾铏彯闂侀潻缍囩紞浣割嚕椤愶箑绠荤紓浣股戝▍銏ゆ⒑鐠恒劌娅愰柟鍑ゆ嫹
H闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾剧懓顪冪€n亝鎹i柣顓炴閵嗘帒顫濋敐鍛婵°倗濮烽崑鐐烘偋閻樻眹鈧線寮村杈┬㈤梻浣规偠閸庮垶宕濇惔銊b偓鍛存倻閼恒儱鈧敻鏌ㄥ┑鍡欏嚬缂併劌顭烽弻娑氣偓锝庝簽鏁堝┑顔硷攻濡炶棄鐣峰Δ鍛殐闁崇懓鐏濇禒锕傛⒒娴e憡鎯堥柟鍐茬箳閹广垽宕奸妷銉х暫闂佹儳娴氶崑鍡欏姬閳ь剙鈹戦鏂や緵闁告﹢绠栧畷锝夊幢濞戞瑢鎷虹紓鍌欑劍钃辩紒鈧埀顒勬⒑缁嬪尅宸ユ繝鈧柆宥呯劦妞ゆ帊鑳堕崯鏌ユ煙閸戙倖瀚�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾剧懓顪冪€n亝鎹i柣顓炴閵嗘帒顫濋敐鍛婵°倗濮烽崑娑⑺囬悽绋挎瀬闁瑰墽绮崑鎰版煕閹邦剙绾ч柣銈呭閳规垶骞婇柛濞у懎绶ゅù鐘差儏閻ゎ喗銇勯弽顐粶缁炬儳顭烽幃妤呮晲鎼粹剝鐏嶉梺缁樻尰閻熲晠寮婚敐鍛傛棃鍩€椤掑嫭鍋嬪┑鐘插椤愪粙鏌ょ喊鍗炲婵☆偒鍨堕弻鐔碱敍閸℃鐏遍柛姘儔濮婃椽宕崟顕呮蕉闂佸憡姊归崹鍧楃嵁閸愵喖围濠㈣泛锕﹂敍婊冣攽閻愭潙鐏﹂柨鏇楁櫆鐎靛ジ鏁撻敓锟�
N闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾剧懓顪冪€n亝鎹i柣顓炴閵嗘帒顫濋敐鍛婵°倗濮烽崑娑⑺囬悽绋挎瀬闁瑰墽绮崑鎰亜閺冨倹鍤€濞存粓绠栭弻娑㈠箛闂堟稒鐏堝Δ鐘靛亼閸ㄨ櫣鎹㈠☉銏犵闁绘垵妫涢崝顖炴⒑閹稿孩绀€闁稿﹤缍婇幃锟犳偄閸忚偐鍘甸梻渚囧弿缁犳垶鏅堕鐐寸厵妞ゆ牗姘ㄦ晶锕傛煙椤旂厧妲婚柍璇查閳诲酣骞嬮悩铏啌闂傚倷绀侀幖顐ゆ偖椤愶箑绀夐柟杈剧畱缁犳牠鏌曢崼婵愭Ц缁炬儳鍚嬬换娑㈠箣閻戝洣绶垫繛瀵搞€嬮幏锟�闂傚倸鍊搁崐鎼佸磹閹间礁纾圭€瑰嫭鍣磋ぐ鎺戠倞妞ゆ帒顦伴弲顏堟偡濠婂嫭顥堢€殿喚绮换婵嬪炊閵婏附鐝冲┑鐘灱濞夋盯鏁冮敃鍌氱闁挎洍鍋撴い顏勫暣婵″爼宕卞Δ鍐啰闂備胶鍘ч崯鍧楁偉閸忛棿绻嗛柟缁㈠枛缁犺櫕淇婇妶鍕厡闁告﹢浜跺娲传閸曨偀鍋撻挊澶嗘灃闁哄洨鍠愬▍蹇涙⒒閸屾瑦绁版い鏇熺墵瀹曟澘螖娴h桨绮寸紓鍌氬€烽懗鑸垫叏閻㈠憡鍎庢い鏍ㄧ◥缁诲棝鏌i幋锝呅撻柡鍛箞閺屽秷顧侀柛鎾跺枛閵嗕線寮崼鐔告闂佽法鍣﹂幏锟�
S濠电姷鏁告慨鐑藉极閸涘﹥鍙忛柣鎴f閺嬩線鏌熼梻瀵割槮缁炬儳顭烽弻锝夊箛椤掍焦鍎撻梺鎼炲妼閸婂潡寮诲☉銏╂晝闁挎繂妫涢ˇ銉х磽娴e搫小闁告濞婂濠氭偄閸忓皷鎷婚柣搴f暩鏋┑鈥茬矙濮婃椽宕崟顒€娅ょ紓浣筋嚙閻楁挸顕f繝姘嵆闁绘棃顥撶粣鐐烘⒑缁洖澧查拑閬嶆煟濠靛洦鈷掔紒杈ㄦ尰閹峰懘宕崟鎴秮閺岋綁骞欓崟顓犵槇閻庢鍠栭…閿嬩繆閹间礁鐓涢柛灞剧煯缁ㄤ粙姊绘担鍛靛綊寮甸鍌滅煓闁硅揪瀵岄弫鍌炴煥閻曞倹瀚�婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柛娑橈攻閸欏繘鏌i幋锝嗩棄闁哄绶氶弻鐔兼⒒鐎靛壊妲紒鐐劤濞硷繝寮婚悢琛″亾閻㈢櫥鐟扮摥缂傚倷娴囩紙浼村磹濠靛钃熼柨鏇楀亾閾伙絽銆掑鐓庣仭濡ゆ棃姊绘担鍛婃儓婵☆偅鎸冲浠嬪礋椤栨锕傛煕閺囥劌鐏犵紒鐘冲▕閺屾盯鍩勯崘锔挎勃婵犮垼顫夊ú鐔奉潖缂佹ɑ濯撮柣鐔煎亰閸ゅ鈹戦悙鏉戠祷缂佺粯锚閻i鎲撮崟顓ф祫闁诲函缍嗘禍婵嬫倵椤掑嫭鈷戦柣鐔告緲閳锋梻绱掗鍛仸鐎殿喗鐓¢獮鏍ㄦ媴閸︻厼寮抽梻浣虹帛濞叉牠宕愰崷顓涘亾濮樼偓瀚�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧湱鈧懓瀚崳纾嬨亹閹烘垹鍊為梺闈浤涢崨顓㈢崕闂傚倷绀佹竟濠囧磻娓氣偓瀹曟洖煤椤忓嫭鐎柣搴秵閸撴岸宕伴幇鎵彄闁搞儯鍔庨埥澶岀磼閻樺磭鍙€闁哄本娲濈粻娑氣偓锝庝簴閸嬫捇寮撮悩鍏哥瑝濠电偞鍨堕悷锝嗙濠婂牊鐓涢柛灞炬皑娴犮垽鏌嶉柨瀣拹妞ゃ劊鍎甸幃娆戔偓娑櫭壕鍐测攽椤旂》榫氭繛鍜冪秮楠炴垿宕熼姣尖晠鏌曟径娑橆洭鐟滅増宀稿缁樻媴閻戞ê娈岄梺鎼炲€栭悧鐘荤嵁韫囨稒鏅搁柨鐕傛嫹婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柛娑橈攻閸欏繘鏌i幋锝嗩棄闁哄绶氶弻鐔兼⒒鐎靛壊妲紒鎯у⒔缁垳鎹㈠☉銏犵婵炲棗绻掓禒楣冩⒑閹肩偛鈧牠宕濋弽顓炍﹂柛鏇ㄥ灠閸愨偓濡炪倖鍔﹀鈧繛宀婁邯濮婅櫣绮欏▎鎯у壈濡炪倖鍨甸ˇ闈涱嚕婵犳碍鍋勯柛蹇曞帶閳ь剟鏀遍妵鍕箳閹存績鍋撴繝姘仒妞ゆ洍鍋撴慨濠冩そ楠炴劖鎯旈敐鍥╂殼婵$偑鍊х紓姘跺础閸愬樊鍤曢柡灞诲劚缁犵懓霉閿濆懏璐¢柛娆忔濮婅櫣绱掑Ο鑽ゎ槬闂佺ǹ锕ゅ﹢閬嶅焵椤掍胶鍟查柟鍑ゆ嫹闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌i幋锝呅撻柛濠傛健閺屻劑寮村Δ鈧禍鎯ь渻閵堝簼绨婚柛鐔告綑閻i绮欑拠鐐閸┾偓妞ゆ帒瀚壕濂告煏婵炲灝鍔楅柡鈧禒瀣厱閻忕偛澧藉銊ф喐閻楀牆绗氶柛瀣典簼閵囧嫰寮村Δ鈧禍楣冩⒑閸濆嫭婀扮紒瀣墵钘濋柧蹇e亖娴滄粓鏌曟繛鍨姢缂佺姾宕甸埀顒侇問閸n噣宕戦崨顖涘床婵犻潧顑呯粈瀣煏婵炲灝鍔欏瑙勬礀铻栭柣姗€娼ф禒婊堟煟韫囨梻绠炵€规洘绻傞~婵嬵敇濠靛牏鐣炬俊鐐€栭崝褏寰婇崸妤€绠犻柛銉㈡杹閸嬫挾鎲撮崟顒傤槰濠电偠灏欓崰鏍嵁閸愵喖顫呴柕鍫濇噽椤ρ囨⒑閸忚偐銈撮柡鍛☉椤曪綁骞庨懞銉㈡嫽婵炶揪缍€濞咃絿鏁☉娆戠闁告瑥顦辨晶鐢碘偓瑙勬礃閸旀瑥鐣烽悜绛嬫晣婵炴垶眉婢规洖鈹戦缁撶細闁稿鎸鹃埀顒佺啲閹凤拷
T濠电姷鏁告慨鐑藉极閸涘﹥鍙忛柣鎴f閺嬩線鏌涘☉姗堟敾闁告瑥绻愰湁闁稿繐鍚嬬紞鎴︽煕閵娿儱鈧骞夐幖浣瑰亱闁割偅绻勯悷鏌ユ⒑缁嬪尅宸ラ柣鏍с偢瀵鈽夐姀鈺傛櫇闂佺粯蓱瑜板啯鎱ㄦ惔銊︹拺婵懓娲ら埀顒侇殜瀹曟垿骞橀懜闈涘簥濠电娀娼уú銊у姬閳ь剟姊虹粙鎸庢拱缂佸鍨甸埢宥夊Χ婢跺鎷洪梺鍛婄缚閸庡崬鐡繝纰樻閸嬪懐鎹㈤崼婵愬殨濠电姵鑹炬儫闂佸啿鎼崐鍛婄閻愮儤鈷戠紒瀣濠€鎵磼鐎n偄鐏存い銏℃閺佹捇鏁撻敓锟�濠电姷鏁告慨鐑藉极閸涘﹥鍙忛柣鎴f閺嬩線鏌涘☉姗堟敾闁告瑥绻愰湁闁稿繐鍚嬬紞鎴︽煕閵娿儱鈧悂婀侀梺缁樓圭亸娆撳箟椤撱垺鐓熼柟杈剧稻椤ュ鐥幆褍鎮戠紒缁樼洴楠炲鎮欓幓鎺撶槗婵犵數鍋犵亸娆愮仚闂佸疇顫夐崹鍧楀箖閳哄啯瀚氱憸宥嗗閹扮増鈷戦柣鐔告緲閺嗚京绱掔紒妯忣亪顢氶敐澶婄婵炴潙顑呴悧姘舵⒑閸撴彃浜為柛鐘虫崌瀹曪綁宕卞☉娆屾嫼缂傚倷鐒﹁摫缂佲偓閳ь剟姊虹粙鍖″伐婵犫偓闁秴鐒垫い鎺嶈兌閸熸煡鏌熼崙銈嗗
W婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柛娑橈攻閸欏繘鏌i姀鐘差棌闁轰礁锕弻鈥愁吋鎼粹€崇缂備焦鍔栭〃鍡樼┍婵犲洤围闁告侗鍘藉▓鏌ユ倵鐟欏嫭绀冮柣鎿勭節瀵鎮㈤悡搴n吋濡炪倖姊婚埛鍫ュ汲椤撱垺鈷戦柟鎯板Г閺佽鲸淇婇銏犳殻鐎殿喛顕ч埥澶愬閻樻彃绁梻渚€娼ф灙闁稿氦娅曠粋鎺楊敇閵忊檧鎷虹紓浣割儏閻忔繈顢楅姀銈嗙厱闁靛ǹ鍎查崑銉р偓娈垮枛椤攱淇婇幖浣哥厸闁稿本鐭花浠嬫⒒娴e懙褰掑嫉椤掑倻鐭欓柟杈惧瘜閺佸倿鏌ㄩ悤鍌涘闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾剧懓顪冪€n亝鎹i柣顓炴閵嗘帒顫濋敐鍛婵°倗濮烽崑鐐烘偋閻樻眹鈧線寮撮姀鈩冩珖闂侀€炲苯澧撮柟顔兼健椤㈡岸鍩€椤掑嫬钃熼柨婵嗘啒閺冨牆鐒垫い鎺戝閸嬪鐓崶銊︾濞戞挸绉磋灃闁挎繂鎳庨弳鐐烘煟閹惧啿鏆熼柟鑼归オ浼村醇濠靛牜妲堕梻浣虹帛濮婂宕㈣閹锋垿鎮㈤崗鑲╁帗闂佸疇妗ㄧ粈渚€寮抽悢鍏肩厽闁绘梻鍎ら崵鈧梺瀹狀潐閸ㄥ潡骞冮埡鍛闁圭儤鎸婚鍕繆閻愵亜鈧洘顨ヨ箛娑樼闁跨噦鎷�